|
中山大学附属第六医院伦理审查申请/报告指南
【目的】 为指导研究者、申办者提交药物/医疗器械临床试验项目、体外诊断试剂临床试验项目、干细胞临床研究项目、医疗新技术及药械通引进临床应用、非注册类临床研究项目的伦理申请,中山大学附属第六医院医学伦理委员会特制定本指南。 【提交伦理审查申请的研究项目范围和依据】 根据国家卫健委发布的《涉及人的生命科学和医学研究伦理审查办法》(2023年)、《涉及人的生物医学研究伦理审查办法》(2016年),国家食品药品监督管理局发布的《药物临床试验质量管理规范》(2020年)、《医疗器械临床试验质量管理规范》(2022年)、《药物临床试验伦理审查工作指导原则》等,所有在我院实施的涉及人的生物医学研究项目,包括下列范围的临床及非临床研究项目,应依据本指南向伦理委员会提交伦理审查申请/报告: l 药物临床试验; l 医疗器械临床试验; l 诊断试剂临床试验; l 医疗新技术及药械通引进临床应用; l 研究者发起的临床研究(含干/体细胞研究); l 非临床研究(只涉及人的微观水平、离体、不含临床信息的生物医学研究,包括使用不可辨认身份的人体样本、数据等开展的研究)
一、审查类型 (一)初始审查(研究开展前) 首次向伦理委员会提交的审查申请。符合上述范围的研究项目,应在研究开始前提交伦理审查申请,伦理委员会根据递交资料决定审查方式(快审或会审),经审查批准后方可实施。根据相关法律法规要求,所有涉及人的医学研究均应在开展前通过审查。
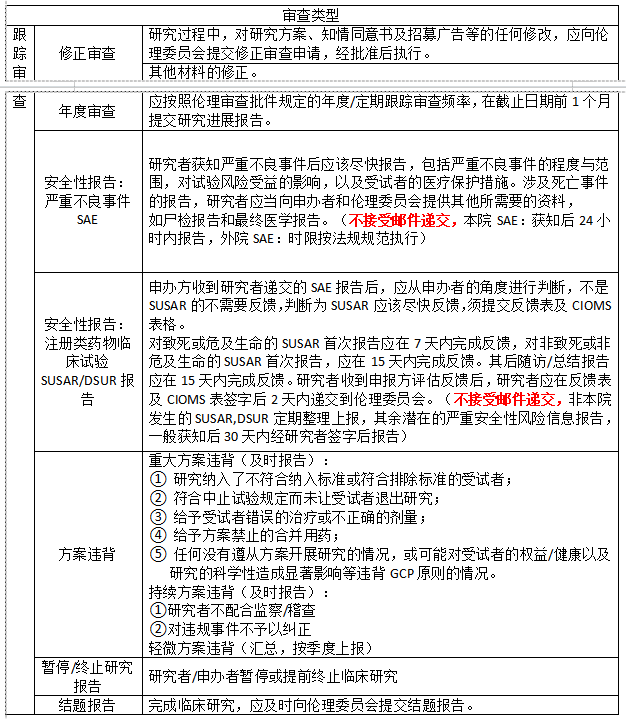
(二)跟踪审查(研究开展中)
(三)复审 上述初始审查和跟踪审查后,按伦理审查意见“作必要修正后同意”,对方案进行修改后,应以“复审”的方式再次送审,经伦理委员会批准后方可实施;如果对伦理审查意见有不同的看法,可以“复审”的方式申述不同意见,请伦理委员会重新考虑决定。
二、提交伦理审查的流程 (一)前置条件(行政部门立项审查):先通过立项审查,方可递交伦理审查申请 (1)注册类临床试验(含新药和医疗器械临床试验、诊断试剂)须经GCP办公室立项。 (2)涉及人的生物医学研究: l 本院研究者发起的临床研究(企业、学会/协会基金资助;无资助)须经临床研究中心办公室立项通过后报送。 l 本院研究者发起的非临床研究(仅收集人体样本和去标识信息)须经科研科审核立项通过后报送。 (3)本院的医疗新技术、新项目须经医政处备案及医疗技术临床应用管理委员会,药械通经相关部门(药学部及委员会等)审查通过后递交。 研究项目的送审责任者一般为主要研究者/课题负责人。申办者一般负责准备送审材料,经主要研究者审批后,由研究护士或主要研究者的课题组递交给伦理办公室。
(二)准备送审文件 申请者应提供对研究项目进行全面、充分的伦理审查所需要的全部文件。 提交文件应满足对临床研究进行全面、完整审查的要求,经审核无误后提供原件一份,会议审查须提供所有包括盖章资料的PDF电子版,快速审查且不通过院内OA递交的须提供两份复印件,请装订成册,并附送审材料目录。 (三)按要求准备审查文件递交清单 (四)文件递交时间 工作日周二、周三、周四这三日的上午现场接收纸质版资料,如遇其他特殊情况,顺延到下一周或另行安排,伦理办公室进行形式审查后回复意见,按形审意见修改重新通过形审后受理,按要求递交纸质版,其余时间电话或邮件沟通。 (五)接受审查的准备 会议时间/地点:办公室秘书会电话/微信通知/邮件通知。 准备会议报告:主要研究者准备报告文件及PPT,PPT及汇报人姓名联系电话等请于会议召开前三天发到邮箱zslyllb@mail.sysu.edu.cn,并应亲自到会报告进行介绍及答疑,提前15分钟到达会场。主要研究者因故不能到会报告,应事先向伦理委员会办公室请假,可由次要研究者代为答辩,临时因故主动取消答辩的,该项目转入下次会议审查。 三、审查决定的传达 (一)传达的形式 初始审查:伦理委员会秘书在伦理委员会做出伦理审查决定后10个工作日内,以“伦理审查批件”或“意见函”的书面方式传达查决定。 跟踪审查: (1)收到修正审查、年度审查及结题报告申请,伦理委员会会及时审查处理,最终会出具意见函或批件。 (2)如果审查意见为肯定性决定(同意继续研究,或不需要采取进一步的措施) ,并且审查类别属于安全性信息报告审查,违背方案审查,伦理委员会的决定可以不传达,也可以传达。申请人在伦理委员会受理送审材料后两个月没有收到伦理委员会的审查意见,视作伦理审查意见为“同意”或“不需要采取进一步的措施”。 (二)收到批准件/意见函的后续步骤 收到批准件后,您需要按批件内容和备注启动或执行项目。 收到意见函后,请按照意见函要求进行修改,并尽快按照复审与重审送审文件清单递交伦理复审申请。届时,伦理委员会将审查确认是否符合要求,并作出书面决定。 若对伦理委员会的审查决定有异议,可以在复审申请中表述不同意见并阐述理由,伦理委员会将重新考虑决定。 四、免除审查 符合以下情况的生物医学研究项目可以申请免除审查: (一)在正常的教育、培训环境下开展的研究;如①对常规或特殊教学方法的研究;②关于教学方法、课程或课堂管理的效果研究,或对不同的教学方法、课程或课堂管理进行对比研究; (二)涉及教育、培训测试(认知、判断、态度、成效)、访谈调查、或公共行为观察的研究。以下情况不能免除审查:①以直接或通过标识符的方式记录受试者信息,可以追踪到受试者;②在研究以外公开受试者信息可能会让受试者承担刑事或民事责任的风险,或损害受试者的经济、就业或名誉;③上述不能免除审查的情况,如果受试者为政府官员或政府官员候选人,或者国家有关法规要求在研究过程中及研究后对私人信息必须保密的情况,则可以免除审查。“涉及访谈调查,公共行为观察的研究”的免除审查一般不适用于儿童与未成年人,除非研究者不参与被视察的公共行为。 (三)对于既往存档的数据、文件、记录、病理标本或诊断标本的收集或研究,并且这些资源是公共资源,或者是以研究者无法联系受试者的方式(直接联系或通过标识符)记录信息的。 (四)食品口味和质量评价以及消费者接受性研究:①研究用健康食品不含添加剂;或②研究用食品所含食品添加剂在安全范围,且不超过国家有关部门标准,或化学农药或环境污染物含量不超出国家有关部门的安全范围。 特殊受试人群免除审查的规定:免除审查不适用于涉及孕妇、胎儿、新生儿、试管婴儿、精神障碍人员和服刑劳教人员的研究。 研究者不能自行做出“免除伦理审查”的判断,应向伦理委员会提交免除审查申请,与研究方案等相关材料,由伦理委员会主任委员或授权者审核确定。 五、免除知情同意签字 以下两种情况可以申请免除知情同意签字: (一)当一份签了字的知情同意书会对受试者的隐私构成不正当的威胁,联系受试者真实身份和研究的唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私的泄露。在这种情况下,应该遵循每一位受试者本人的意愿是否签署书面知情同意文件。 (二)研究对受试者的风险不大于最小风险,并且如果脱离“研究”背景,相同情况下的行为或程序不要求签署书面知情同意。例如,访谈研究,邮件电话调查。 对于批准免除签署书面知情同意文件的研究项目,伦理委员会可以要求研究者向受试者提供书面告知信息。 六、免除知情同意 (一)利用以往临床诊疗中获得的医疗记录和生物标本的研究,并且符合以下全部条件,可以申请免除知情同意: 1、研究目的是重要的。 2、研究对受试者的风险不大于最小风险。 3、免除知情同意不会对受试者的权利和健康产生不利的影响。 4、受试者的隐私和个人身份信息得到保护。 5、若规定需获取知情同意,研究将无法进行(病人/受试者拒绝或不同意参加研究,不是研究无法实施、免除知情同意的理由)。 6、只要有可能,应在研究后的适当时候向受试者提供适当的有关信息。 若病人/受试者先前已明确拒绝在将来的研究中使用其医疗记录和标本,则该受试者的医疗记录和标本只有在公共卫生紧急情况需要时才可被使用。 (二)利用以往研究中获得的医疗记录和生物标本的研究(研究病历/生物标本的二次利用),并且符合以下全部条件,可以申请免除知情同意: 1、以往研究已获得受试者的书面同意,允许其他的研究项目使用其病历或标本。 2、本次研究符合原知情同意的许可条件。 3、受试者的隐私和身份信息的保密得到保证。 (三)科研课题研究 必须符合以下其中一个条件才可以申请免除知情同意书: 1、利用可识别身份信息的人体材料或者数据进行研究,已无法找到该受试者,且研究项目不涉及个人隐私和商业利益的。 2、生物样本捐献者已经签署了知情同意书,同意所捐献样本及相关信息可用于所有医学研究的。 七、审查收费标准: 项目类别伦理审查费(会议审查及跟踪审查)备注初始审查(本院及中大附属单位发起的项目可申请免除缴纳费用)5000元 复审1000元 修正审查1000元 安全性信息报告审查不收费 方案违背审查不收费 结题审查不收费 年度审查不收费 资料备案不收费其他中心发生的不良事件、方案违背等
汇款账户名:中山大学附属第六医院账号:44058401040005051开户行:中国农业银行广州员村二横路支行; 转账时请备注注明PI名字+伦理审查受理编号+伦理审查费(初审/复审/修正)。 请申报方填写后打印收费模板,初审项目待形式审查通过后生成伦理编号后填写。 八、会议频率 伦理委员会审查时间约为每月1次(一般不超过2个月)。一般为每月第三周的周二下午例行召开审查会议(如有调整,以实际通知为准),待审项目数达5项或以上则召开会议审查,如当月待审项目数量不足则将顺延。如遇紧急事件则随时召开会议。 伦理审查批准后两年内未开展试验、未与伦理办公室联系的项目按批件失效处理。 九、联系方式 伦理委员会办公室电话:020-38379764 Email:zslyllb@mail.sysu.edu.cn
十、附件表格 审查递交材料清单 审批件信息采集表 收费通知模板
|




 官方微博
官方微博 微信服务号
微信服务号 微信订阅号
微信订阅号